مبانی سلهای الکتریکی – ویژگی یک واکنش شیمیایی در این واقعیت پنهان است که انجام آن همراه با گرفتن و یا دادن الکترون همراه است. این نوع واکنش را به صورت زیر نشان می دهند.
اصول خوردگی

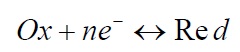
که در آن Red عامل کاهنده (دهنده الکترون) و OX عامل اکسنده (دریافت کننده الکترون). و n تعداد الکترون های (-e) شرکت کننده در واکنش است.
یک عامل کاهنده و یک عامل اکسنده را که طبق واکنش بالا به هم ربط پیدا می کنند. اغلب زوج اکسایش – کاهش و واکنش را واکنش اکسایش-کاهش می نامند.
در یک محلول، الکترون به صورت آزاد وجود ندارند، لذا الکترون های که منتشر می شوند. در یک واکنش اکسایش باید همزمان با انجام یک واکنش کاهش به مصرف برسد.
یک راه حل ممکن برای این منظور آن است که تماس بین واکنش اکسنده و کاهنده. که هر دو در محلول وجود دارند انجام گیرد، برای مثال:
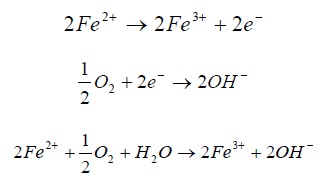
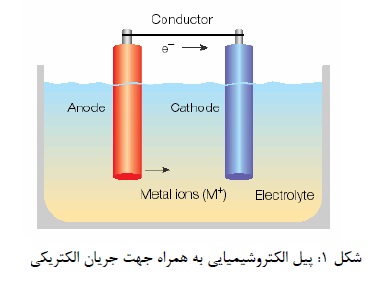
راه دیگر، انجام واکنش در یک پیل الکتروشیمیایی مطابق (شکل1) است. یک پیل الکتروشیمیایی از نوع معمولی شامل دو الکترود است که توسط الکترولیت با هم در ارتباط هستند. الکترودها از جنس رسانای الکترون درست می شوند. مانند یک فلز که در تماس با یک الکترولیت است. الکترولیت اغلب یک محلول آبی است که قادر به رسانش الکتریسیته است. از ویژگی الکترولیت این است که جریان در داخل آن به وسیله یونها انتقال می یابند. الکترودی که از آن جریان الکتریسیته مثبت وارد الکترولیت می شود. آند و الکترودی که از آن، جریان الکتریسیته، الکترولیت را به سمت الکترود ترک می کند کاتد نام دارند.
عبور جریان الکتریسیته از سطح یک الکترود در یک جهت یا در جهت دیگر همواره با یک واکنش الکتروشیمیایی همراه است. که آن را در یک واکنش الکترودی می نامند. واکنش الکترود در آند یا واکنش آندی همواره یک واکنش اکسایش است و واکنش کاتدی همواره یک واکنش کاهش می باشد.
یک پیل الکتروشیمیایی که در آن عبور جریان به کمک نیروی یک منبع خارجی صورت می گیرد، پیل الکترولیتی نام دارند. یک پیل الکتروشیمیایی را که خود جریان الکتریکی را تولید می کند را پیل گالوانیکی می نامند.
قانوان فارادی
نتیجه ورود جریان به الکترولیت خروج آن از الکترولیت همواره با واکنش های الکترودی همراه است. که به صورت تغییراتی در سازنده های الکترود یا محیط اطراف الکترود ظاهر می شوند. کمیت های تبدیل شده در طی واکنش های الکترودی متناسب است با مقدار جریانی که از سطح الکترود عبور می کند. و این پدیده بر طبق فاردای تعریف می شود. بر طق این قانون، برای تبدیل یک مول الکترون (-e) ، 96500 کولن (آمپر ثانیه) یا 26/8 (آمپر-ساعت) الکتریسیته لازم است.
بازدهی جریان برای یک واکنش الکترودی معین بخشی ا جریان است که برای انجام واکنش در سطح الکترود لازم است. مابقی جریان توسط واکنش های دیگر الکترودی مصرف می شود که به طور همزمان در سطح الکترود دیگر انجام می گیرد.
قطبش
هرگاه یک قطعه فلز Me. در داخل محلول آبی حاوی یون های فلزMe +n قرار داشته باشد. در این صورت، واکنش الکترودی در سطح الکترود صورت می گیرد و آن قدر ادامه می یابد تا به تعادل برسد:
اصول خوردگی
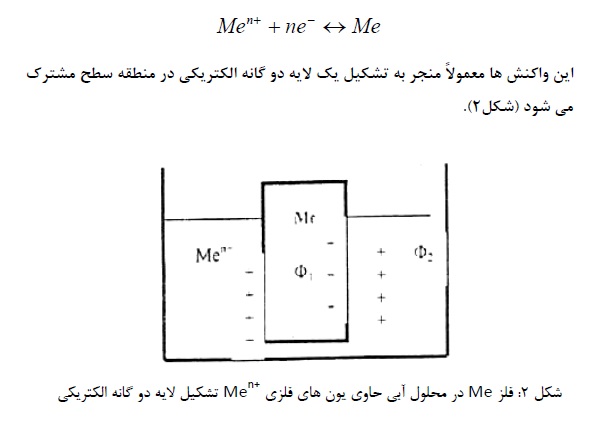
وجود این لایه مضاعف الکتریکی به این معنی است. که اکنون قطعه فلز دارای یک پتانسیل الکتریکی به نام پتانسیل گالوانیکی (1 Φ) در مقابل پتانسیل گالوانیکی محلول (2 Φ) است.
اصول خوردگی
اختلاف پتانسیل گالوانیکی ( 2 Φ) – (Φ 1) را معمولاً با اندازه گیری مستقیم نمی توان تعیین کرد. ولی مقدار نسبی آن را می توان با مقایسه پتانسیل گالوانیکی تفاضلی الکترود مرجع اندازه گرفت.
مکانیزم الکتروشیمیایی
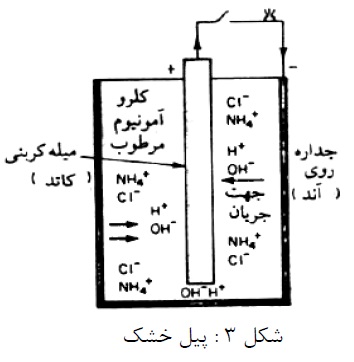
فرآیند خوردگی غالباً الکتروشیمیایی است. عملکرد خوردگی در محیط آبی مشابه مکانیزم یک پیل می باشد. که از یک الکترود ذغال در وسط، بدنه فلز روی و الکترولیت NH4CI متشکل است. نقش گرانول های کربن برای بهبود هدایت و دی اکسید منگنز بعنوان وا قطبی کننده در اینجا مطرح نیست. هنگامی که لامپی به دو قطب پیل وصل شود، روشن میشود و انرژی الکتریکی برای روشن ماندن لامپ توسط واکنش دو الکترود تأمین می گردد. در الکترود ذغالی (قطب مثبت)، احیاء شیمیایی صورت می گیرد. و در الکترود منفی اکسایش شیمیایی صورت میپذیرد و فلز روی به یون روی هیدارته مبدل می گردد.
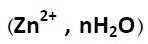
اصول خوردگی
و خواهیم داشت:
KIT=وزن فلز وکنش کننده
K= معادل الکتروشیمیایی (گرم در کولمب)
I= جریان برحسب آمپر
T= زمان بر حسب ثانیه
معادل الکتروشیمیایی یا معادل یک کولمب وزن (گرم) که معادل یک کولمب جریان الکتریسیته می باشد. و از تقسیم وزن هم ارز (گرم=اکی والان گرم) هر عنصر یا بنیان بر حسب گرم بر عدد فارداه بدست می آید.
در مورد فلز روی معادل الکتروشیمیایی برابر4- 10 × 3/39 گرم بر کولن است. اگر دو قطب اتصال کوتاه شوند، ظرف چند ساعت بدنه پیل سوراخ می شود. اگر دو قطب وصل نباشند روی سالها دست نخورده باقی می ماند. و اگر به مقدار کمی مصرف شود مربوط به وجود ناخالص های سطح فلز روی (نظیر آهن) می باشد. که به دلیل تشکیل پیل های موضعی است. که باعث کمی گرما در اطراف خود می شود (شکل 4).
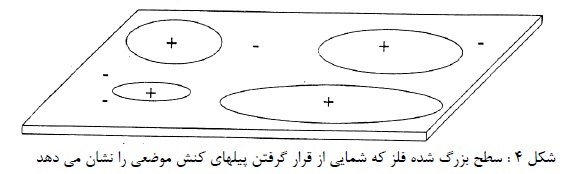
تا زمانی که سطح فلز خشک بماند جریان موضعی و خوردگی ناشی از آن وجود نخواهد داشت. ولی در معرض آب و محلول های آبی این پیل ها شروع به فعالیت نموده. واکنش تبدیل شیمیایی فلز به محصول خوردگی آغاز می گردد. و به عبارت دیگر غالباً عامل خوردگی در آب، قلیایی ها، اسیدها و محلول های نمک می باشند. هرگاه ناخالصی های فلز تشکیل دهنده الکترودهای پیل موضعی باشند، فلز فاقد ناخالصی دارای مقاومت چشم گیر در برابر خوردگی خواهد بود.
آلومینیوم و منیزیم تجارتی در مقایسه با نوع خالص در آب دریا و اسیدها مقاومت کمتری در برابر خوردگی دارند. همین حالت در مورد فلز روی در اسید کلریدریک وجود دارد. ولی همیشه وضعیت به این منوال نیست. انواع دیگری از پیل های خوردگی نیز می توانند در اثر تغییرات محیطی، مانند غلظت یا دما فعال باشند. این نوع پیل ها بعداً مورد بحث قرار خواهند گرفت.
بعنوان مثال هنگامی که در آب پر از هوا قرار می گیرد. الکترود منفی سطوح پوشش می شود، با احتمالاً زنگ متخلخل (اکسید آهن) می باشد. و الکترود مثبت نواحی در معرض اکسیژن الکترودهای مثبت و منفی با پیشرفت واکنش خوردگی با یکدیگر تعویض میشود. تغییر مکان می دهند و بر این روال آهن تجارتی و خالص در آب اشباع شده از هوا با سرعت یکسانی خورده می شوند.
اصول خوردگی
تشکیل پیلها با دو الکترود
دو هادی الکتریکی (الکترود) فرو برده شده در یک الکترولیت پیل گالوانیکی را تشکیل می دهند. اگر دو قطب این پیل توسط یک هادی به همدیگر اتصال کوتاه گردد. از طریق سیم جریان مثبت از قطب مثبت به منفی برقرار می گردد. در یک هادی فلزی جریان توسط حامل های بار منفی صورت می گیرد. و در حقیقت جریان الکتریسیته حرکت الکترون ها در فلز می باشند. طبق قرارداد، مراد از جریان الکتریسیته حرکت جریان مثبت از قطب مثبت به منفی می باشند. هرجایی که از جریان نام برده نشود، منظور بار مثبت می باشد.
در درون الکترولیت جریان توسط دو نوع حامل بار مثبت و منفی برقرار می گردد. یون نامیده می شوند. جریان حمل شده توسط هر یون بستگی به بار الکتریکی و تحرک آن یون دارد. کل جریان مثبت و منفی.الکترودی که در آن اکسایش شیمیایی صورت می گیرد (جریان مثبت از الکترود خارج و به داخل الکترود واد می گردد) آند نامیده می شود.
نمونه های واکنش آندی:
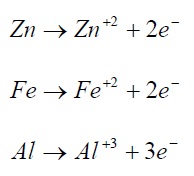
الکترودی که در آن احیاء شیمیایی رخ می دهد (جریان مثبت از الکترولیت به الکترود وارد می شود) کاتد خوانده می شود.
نمونه های واکنش کاتدی:
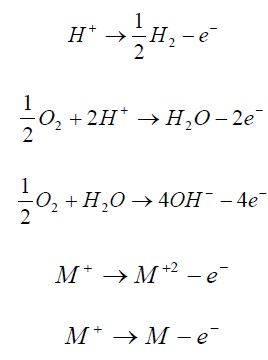
واکنش اکسایش یا آندی افزایش ظرفیت یون و تولید الکترون را در بر دارد. و کاهش ظرفیت یون و مصرف الکترون نشانه واکنش کاتدی یا احیاء می باشد. واکنش های کاتدی و آندی باید همزمان و با یک سرعت در نواحی مربوطه روی سطح فلز انجام شوند. اگر چنین نباشد باید فلز خود به خود باردار گردد. که غیر ممکن است.
و در حقیقت مهمترین اصل در خورندگی برابر بودن سرعت اکسایش با سرعت احیاء می باشد. (از نقطه نظر تولید و مصرف الکترون) ممکن است در یک واکنش خوردگی چند واکنش اکسایش یا احیاء صورت بگیرد. از آنجا که واکنش های اکسایش و احیائی که در حین خوردگی رخ می دهند به هم وابسته می باشند. می توان با کاهش سرعت هر یک از این دو نوع واکنش، خوردگی را کند نمود.
مثلاً اگر سطح فلز با رنگ یا پوششی غیرهادی پوشنده شود. سرعت هر دو واکنش کاتدی و آندی را کاهش می دهد. یا کاهش سرعت واکنش کاتدی یا آندی به کمک افزودن درصد ناچیز ممانعت کننده کاهش می یابد.
انواع پیل
پیل ها از نظر ساختاری به دو دسته 1- پیل های با الکترود غیر مشابه 2- پیل های با الکترود مشابه تقسیم بندی می شوند.
1- پیل الکترودهای غیر مشابه
این پیل قبلاً با مثال پیل خشک تشریع شده است. این پیل ها از دو فلز (الکترود) غیر همنام و سیالی به نام الکترولیت تشکیل شده اند. به عنوان مثال، فلزی که بر روی سطح خود دارای ناخالصی های هادی الکتریسیته به صورت فاز جداگانه است. لوله مسی در تماس با لوله آهنی، فلز کار سرد شده در تماس با همان فلز که آنیل شده است. فلز مرزدانه در تماس با فلز خود دانه، یک کریستال در یک جهت آرایش با کریستالی. در آرایش متفاوت همگی نمونه هایی از پیل های غیر مشابه می باشند (شکل 5).
2-پیل الکترودهای مشابه
این پیل ها از دو فلز (الکترود) همنام که دارای تاریخچه یکسان باشند و سیالی به نام الکترولیت تشکیل می شود. منظور از تاریخچه یعنی تمامی عملیاتی که بر روی فلز آند از قبیل ترکیب شیمیایی، روند تولید، عملیات حرارتی. عملیات ماشینکاری و غیره انجام می گیرد، بر روی فاز کاتد نیز انجام گردد. این پیل ها به سه دسته پیل های اختلاف غلظت، پیل های اختلاف دمشی و پیل های اختلاف درجه حرارت تقسیم بندی می شوند.
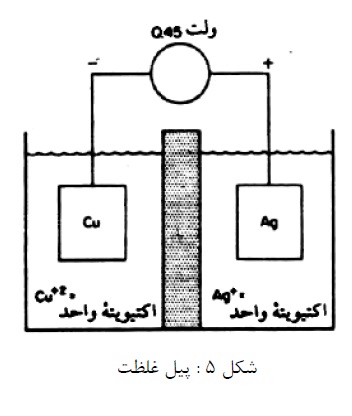
3- این پیل ها دارای دو الکترود مشابه در تماس با محلول های با ترکیب شیمیایی متفاوت می باشند. نمونه ای از پیل اختلاف غلظت، پیل غلظت نمکی می باشد، مانند مس در سولفات مس رقیق (آند) و مس در سولفات مس غلیظ (کاتد). مس در محلول رقیق تر حل و در محلول غلیظ تر را سبب می شود (شکل 6).
واکنش های آندی و کاتدی به شرح ذیل می باشد:
اصول خوردگی
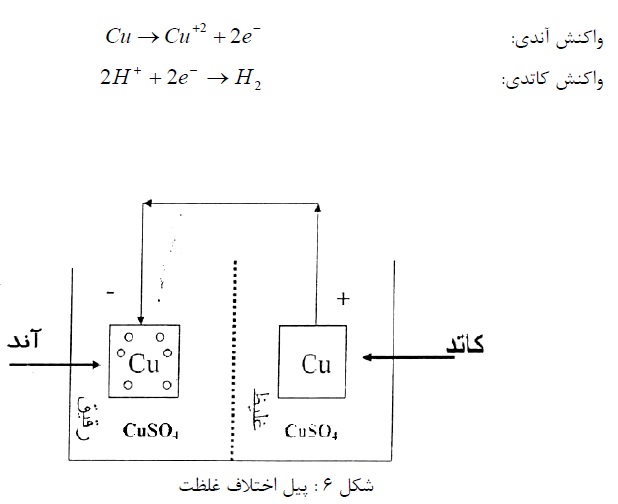
4- پیل های اختلاف دمشی
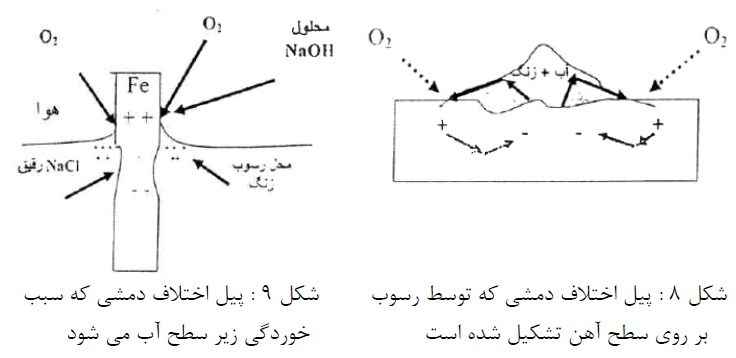
نوع دوم پیل، اختلاف دمشی می باشد و در عمل اهمیت زیادی دارد. این پیل را می توان با دو الکترود آهن در محلول رقیق کلرید سدیم نشان داد که اطراف یک الکترود (کاتد) اشباع از هوا باشد. (با دمیدن هوا در محلول) و اطراف الکترود دیگر (آند) فاقد هوا (با دمیدن نیتروژن در محلول). اختلاف غلظت هوا موجب اختلاف پتانسیل و برقراری جریان می گردد (شکل7).
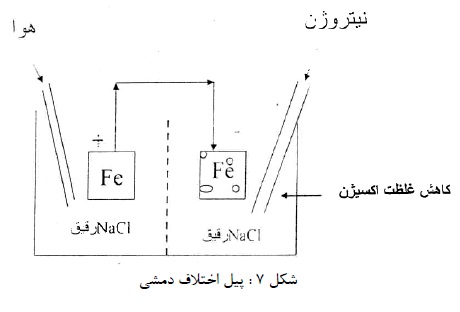
این پیل در شیارها و زیر رسوبات یا خط سطح آب می تواند موجب خوردگی گردد (شکل های 8 و 9).
در زیر رسوب یا سطح آب غلظت اکسیژن کمتر از قسمت های در معرض هوا می باشد. در مورد فلزات و آلیاژهای روئین در معرض آب دریا این پیل سبب خوردگی خواهد شد.
اصول خوردگی
5- پیل اختلاف دما
اجزاء این پیل الکترودهایی از یک فلز با دمای متفاوت و در الکترولیت با ترکیب شیمیایی اولیه یکسان می باشند. در مورد مبنای تئوری و اهمیت علمی آن اطلاعات کمی وجود دارد و احتملاً در دستگاهایی مانند مبدل های حرارتی. گرم کننده های مغروق، جوشاننده ها و نظیر آنها فعال می باشد. در محلول سولفات مس الکترود مس گرم تر کاتد و الکترود سردتر آند است.
اصول خوردگی
سرب نیز به همین شکل می باشد. ولی قطب ها در مورد نقره عکس است. در مورد آهن در محلول رقیق کلرید سدیم حاوی هوا الکترود گرمتر نسبت به سردتر آند می باشد. و در مدتی حدود چند ساعت بسته به سرعت حرکت محلول و اتصال کوتاه بودن یا نبودن قطب ها معکوس می شوند. در عمل پیل های خوردگی ممکن است تلفیقی از هر سه نوع مورد بررسی باشند.
جداول اکسایش و کاهش
زمانی که یک واکنش الکتروشیمیایی از حالت تعادل خود دچار آشفتگی می گردد. پایداری نسبی نمونه ها در واکنش تغییر می کند. که این تغییر به واسطه آشفتگی، مربوط به پتانسیل الکترود اندازه گیری گردید که با پتانسیل الکترود تعادل واکنش متفاوت است. اگر پتانسیل الکترود مورد اندازه گیری نسبت به پتانسیل الکترود تعادل مثبت باشد. واکنش ذیل بطور برگشت ناپذیر از چب به راست پیش می رود و برعکس.
-ne+ نمونه اکسید شده = نمونه های احیاء شده
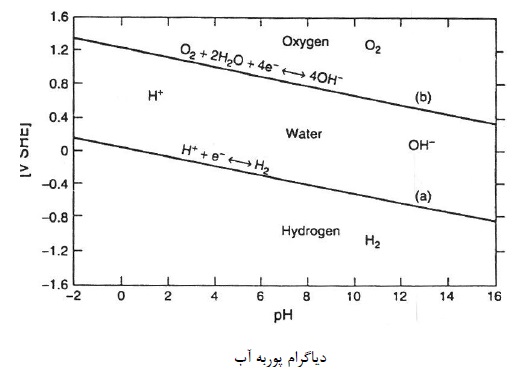
دیاگرام های پوربه رابطه بین پتانسیل های الکترود واکنش های الکتروشیمیایی و PH را نشان می دهند. و این دیاگرام ها در تشخیص پایداری نواحی مربوط به نمونه های شیمیایی مختلف در محلول کمک شایانی می نمایند.
با توجه به دیاگرام پوربه H2O می توان پی برد که آب در پتانسیل های بین خطوط a و b پایدار بوده. و در خارج آن ناپایدار می باشد. همچنین مطابق این دیاگرام فلزات از نظر فعالیت به 5 دسته تقسیم می شوند:
1-فلزات خیلی نجیب
پتانسیل احیای فلزاتی مانند طلا، نقره و پلاتین بسیار بالاتر از پتانسیل احیای آب می باشد. بنابراین، این گونه از فلزات اصلاً نیازی به حفاظت کاتدی ندارند.
2- فلزات نجیب
پتانسیل احیای این فلزات (مانند مس) بین پتانسیل احیای آب و پتانسیل احیای هیدروژن می باشد. بنابراین، این نوع فلزات در محیط های بدون اکسیژن خوردگی پیدا نمی کنند. ولی در محیط های اکسیژن نیاز به حفاظت کاتدی دارند.
3- فلزات فعال
پتانسیل این گونه فلزات (مانند آهن) زیر پتانسیل احیای هیدروژن می باشد. بنابراین، این فلزات در محیط های حاوی اکسیژن در تمام pH ها باید حفاظت شوند. و در محیط های بدون اکسیژن در pH های اسیدی نیاز به حفاظت دارند.
اصول خوردگی
4-فلزات خیلی فعال
پتانسیل این گونه فلزات (همانند آلومینیوم، تیتانیوم) بسیار کمتر از پتانسیل احیای هیدروژن می باشد. بنابراین اینگونه فلزات در هر محیط و در هر pH نیاز به حفاظت خواهند داشت. این فلزات به محض قرار گیری در این گونه محیط ها و به محض نشست لایه اکسید روی آنها رویین می شوند. همچنین جریان خیلی زیادی جهت حفاظت آنها نیاز می باشد.
اصول خوردگی
5-فلزات رویین شونده
این فلزات در محیط ابتدا خوردگی پیدا می کنند. و لایه اکسید تشکیل می گردد و این لایه مانند سپری از خوردگی فلز جلوگیری می کنند. در این حالت لازم نیست که جریان آن قدر وارد شود تا پتانسیل به E0 فلز برسد. بلکه می توان جریان را به اندازه ای تزریق کرد که پتانسیل فلز در محدودۀ پتانسیل رویین شدن قرار گیرد.
اختلاف پتانسیل بین فلزات تحت شرایط غیر خورنده می تواند اساس پیش بینی تمایل خوردگی بیان شود. بطور خلاصه، پتانسیل بین فلز در تماس با محلول حاوی تقریباً یک اتم گرم یون فلز مربوطه (اکتیویته واحد). در یک درجه حرارت ثابت به دقت اندازه گیری می شود. جدول 1، که غالباً جدل نیروی الکتروموتوری یا جدول emf نام دارد. طرز قرار گیری فلزات مختلف را نسبت به یکدیگر نشان می دهد. برای سادگی کلیه پتانسیل ها را نسبت به یک الکترود مرجع +H2 / H که بطور دلخواه صفر فرض می شود می سنجند.
پتانسیل بین فلزات مختلف را با گرفتن اختلاف بین پتانسیل استاندارد emf آنها حساب می کنند. مثلاً اختلاف پتانسیل بین الکترودهای مس و نقره 0/462 ولت است. اختلاف پتانسیل بین مس و روی 1/1 ولت است. برای آلیاژهایی که از دو یا چند جزء فعال تشکیل می شوند. بدست آوردی پتانسیل آزاد عملی نیست. لذا در جدول 1 فقط فلزات خالص وجود دارند.